核准日期:2022年01月30日
修改日期:
盐酸左西替利嗪口服溶液说明书
请仔细阅读说明书并在医师指导下使用
【药品名称】
通用名称:盐酸左西替利嗪口服溶液
英文名称:Levocetirizine Dihydrochloride Oral Solution
汉语拼音:Yansuan Zuoxitiliqin Koufurongye
【成份】
本品主要成份为盐酸左西替利嗪。
化学名称:(R)-[2-[4-[(4-氯苯基)苯甲基]-1-哌嗪基]-乙氧基]乙酸二盐酸盐
化学结构式:
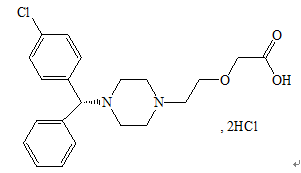
分子式:C21H25ClN2O3·2HCl
分子量:461.81
【性状】
本品为无色的澄清液体。
【适应症】
荨麻疹、过敏性鼻炎、湿疹、皮炎、皮肤瘙痒症等。
【规格】
0.05%(150ml︰75mg)
【用法用量】
12岁及以上青少年和成人:每晚一次,每次5mg(10ml)。某些患者可每晚一次,每次2.5mg(5ml)。
6~11岁儿童:每晚一次,每次2.5mg(5ml)。
6个月~5岁儿童:每晚一次,每次1.25mg(2.5ml)。
12岁及以上青少年和成人肝肾功能损害患者的剂量调整:
l轻度肾功能损害者(肌酐清除率CLCR=50~79ml/min):每日一次,每次2.5mg(5ml)。
l中度肾功能损害者(CLCR=30~49ml/min):每隔一日一次,每次2.5mg(5ml)。
l严重肾功能损害者(CLCR=10~29ml/min):每周2次(平均每3~4日一次),每次2.5mg(5ml)。
l肾病晚期患者(CLCR<10ml/min)和正在透析患者,不得服用本品。
11岁以下肾功能损害儿童患者禁用。
仅肝功能损害者不用调整剂量,同时肝、肾功能损害者推荐调整剂量。
本品可与食物同服,也可单独服用。
【不良反应】
嗜睡、疲劳、乏力和尿潴留与盐酸左西替利嗪应用相关。
1.临床试验经验
在14项为期1周至6个月的对照临床试验中,2708例暴露于左西替利嗪的过敏性鼻炎和慢性特发性荨麻疹患者显示出下述安全性数据。
成人和青少年的短期(暴露时间达6周)安全性数据是基于8项涉及1896例患者(男性825例、女性1071例)用左西替利嗪每晚一次,每次2.5、5mg等治疗的临床试验。
儿科患者的短期安全性数据是基于2项涉及243例患有过敏性鼻炎的儿童(6~12岁的男性162例、女性81例)用左西替利嗪治疗4至6周的临床试验,一项114例患有过敏性鼻炎或慢性特发性荨麻疹的儿童(1~5岁的男性65例、女性49例)用左西替利嗪治疗2周的临床试验,和一项45例患有过敏性鼻炎或慢性荨麻疹症状的儿童(6~11个月的男性28例、女性17例)用左西替利嗪治疗2周的临床试验。
成人和青少年的长期(暴露4或6个月)安全性数据是基于2项涉及428例过敏性鼻炎患者(男性190例、女性238例)用左西替利嗪每日一次、每次5mg治疗的临床试验。一项涉及255例12~24个月患者用左西替利嗪治疗18个月的临床试验也提供了长期安全性数据。
因为临床试验是在各种条件下进行的,一种药物在各临床试验所观察到的不良反应发生率不能直接与另一种药物在一项临床试验中的发生率相比较,也不能反映实践中观察到的发生率。
12岁及以上青少年和成人
在为期6周的试验中,成人和青少年患者的平均年龄为32岁,44%为男性、56%为女性,绝大部分(超过90%)为白种人。
试验中服用左西替利嗪2.5mg和5mg的试验组分别有43%和42%的受试者至少有1例不良事件,而安慰剂组有43%。
在为期1至6周的安慰剂对照试验中,最常见的不良反应为嗜睡、鼻咽炎、疲劳、口干和咽炎,多数程度为轻到中度。左西替利嗪引起的嗜睡随试验剂量2.5mg、5mg等排序,是导致中断试验(0.5%)的最常见不良反应。
表1列出8项安慰剂对照临床试验中12岁及以上受试者暴露于左西替利嗪2.5mg或5mg时报告的发生率超过或等于2%、同时比安慰剂组发生率高的不良反应。
表1.为期1至6周的安慰剂对照临床试验中12岁及以上受试者暴露于左西替利嗪每日一次、每次2.5mg或5mg时报告的≥2%的不良反应
不良反应 | 左西替利嗪2.5mg (n=421) | 左西替利嗪5mg (n=1070) | 安慰剂 (n=912) |
嗜睡 | 22(5%) | 61(6%) | 16(2%) |
鼻咽炎 | 25(6%) | 40(4%) | 28(3%) |
疲劳 | 5(1%) | 46(4%) | 20(2%) |
口干 | 12(3%) | 26(2%) | 11(1%) |
咽炎 | 10(2%) | 12(1%) | 9(1%) |
12岁及以上青少年和成人暴露于左西替利嗪时所见发生率高于安慰剂组的其他不良反应有昏厥(0.2%%)和体重增加(0.5%)。
6~11岁儿科患者
2项短期安慰剂对照、双盲临床试验中共有243例6~11岁儿科患者服用左西替利嗪。患者平均年龄为9.8岁,6~8岁有79例(32%),50%为白种人。表2列出安慰剂对照临床试验中6~11岁受试者暴露于左西替利嗪时报告的发生率超过或等于2%、同时比安慰剂组发生率高的不良反应。
表2.为期4和6周的安慰剂对照临床试验中6~11岁受试者暴露于左西替利嗪时报告的≥2%的不良反应
不良反应 | 左西替利嗪 (n=243) | 安慰剂 (n=240) |
发热 | 10(4%) | 5(2%) |
咳嗽 | 8(3%) | 2(<1%) |
嗜睡 | 7(3%) | 1(<1%) |
鼻出血 | 6(2%) | 1(<1%) |
1~5岁儿科患者
一项为期2周的安慰剂对照、双盲安全性试验中共有114例1~5岁儿科患者服用左西替利嗪。患者平均年龄为3.8岁,1~2岁占32%,71%为白种人、18%为黑人。表3列出安慰剂对照安全性试验中1~5岁受试者暴露于左西替利嗪时报告的发生率超过或等于2%、同时比安慰剂组发生率高的不良反应。
表3.为期2周的安慰剂对照安全性试验中1~5岁儿科受试者暴露于左西替利嗪时报告的≥2%的不良反应
不良反应 | 左西替利嗪 (n=114) | 安慰剂 (n=59) |
发热 | 5(4%) | 1(2%) |
腹泻 | 4(4%) | 2(3%) |
呕吐 | 4(4%) | 2(3%) |
中耳炎 | 3(3%) | 0(0%) |
6~11个月儿科患者
一项为期2周的安慰剂对照、双盲安全性试验中共有45例6~11个月儿科患者服用左西替利嗪。患者平均年龄为9个月,51%为白种人、31%为黑人。安慰剂对照安全性试验中6~11个月受试者暴露于左西替利嗪时报告的发生率超过1例(例如,≥3%受试者)、同时比安慰剂组发生率高的不良反应包括腹泻和便秘,在左西替利嗪和安慰剂治疗组分别各报告有6例(13%)和1例(4%)、3例(7%)和1例(4%)。
长期临床试验经验
2项对照临床试验中,428例12岁及以上患者(男性190例、女性238例)用左西替利嗪每日一次、每次5mg治疗4或6个月。患者特征与安全性特性与短期试验中所见相似。10例患者(2.3%)因嗜睡、疲劳或乏力中断试验,与之相比,安慰剂组有2例(<1%)。
未进行12岁以下过敏性鼻炎或慢性特发性荨麻疹儿科患者的长期临床试验。
实验室检查异常
临床试验中有<1%患者报告有血胆红素和转氨酶一过性升高,未导致任何患者中断试验。
2.上市后经验
在临床试验期间报告的和上述所列的不良反应之外,左西替利嗪上市后也确认了不良反应。由不确定样本量人群主动报告的不良反应,不可能确切估计其发生率或建立与药物暴露量的因果关系。报告的不良反应有:超敏性和过敏反应、食欲增加、血管性水肿、固定性药疹、瘙痒、皮疹和荨麻疹、抽搐、感觉异常、头晕、战栗、味觉障碍、眩晕、运动障碍(包括肌张力失常和动眼危象)、易激惹和骚动、幻觉、抑郁、失眠、自杀意念、视觉紊乱、视力模糊、心悸、心动过速、呼吸困难、恶心、呕吐、肝炎、排尿困难、尿潴留、肌痛、关节痛和水肿。
除了这些左西替利嗪治疗时报告的反应,西替利嗪上市后经验中也报告有其他可能的严重不良事件。因左西替利嗪是西替利嗪的主要活性成分,应考虑下述不良事件在左西替利嗪治疗时有可能出现:口面运动障碍、严重低血压、胆汁淤积、肾小球性肾炎、死胎、抽搐、肌痉挛、锥体外系症状和急性泛发性发疹性脓疱病(AGEP)。
【禁忌】
对左西替利嗪、西替利嗪或其他哌嗪类衍生物,以及本品其他辅料过敏者禁用。
肾病晚期患者(CLCR<10ml/min)和透析患者禁用。
11岁以下肾功能损害儿童患者禁用。
【注意事项】
1.嗜睡:临床研究中报道盐酸左西替利嗪治疗时某些患者出现嗜睡、疲劳和乏力,从事危险职业、驾驶或操纵机器者应慎用。由于可能发生额外的警觉性降低以及对中枢神经系统性能的额外损害,应避免盐酸左西替利嗪与酒精或其他中枢神经系统镇静剂合并使用。
2.尿潴留:盐酸左西替利嗪上市后报道有尿潴留,有尿潴留发病诱因(如脊髓损伤、前列腺增生)的患者应慎用。出现尿潴留后应停用盐酸左西替利嗪。
【孕妇及哺乳期妇女用药】不适用。
【儿童用药】
见【用法用量】。
【老年用药】同成人。
【药物相互作用】
体外数据说明左西替利嗪不可能通过抑制或诱导肝药物代谢酶而产生药代动力学相互作用。尚未进行左西替利嗪体内药物相互作用的研究。消旋西替利嗪进行的药物相互作用研究显示:消旋西替利嗪与安替比林、伪麻黄碱、红霉素、阿奇霉素、酮康唑和西咪替丁间无相互作用。400mg剂量的茶碱导致西替利嗪的清除率有较小的降低,可能是由于较高的茶碱剂量具有较强的效果。利托那韦增加西替利嗪的血浆AUC约42%,并伴有半衰期延长(53%)和清除率下降(29%),同时服用西替利嗪不能改变利托那韦的行为。
【药物过量】
剂量过量时成人的症状可能包括嗜睡。在儿童起初可能出现焦虑或坐立不安,随后嗜睡。本品无特效拮抗剂。一旦发生剂量过量,推荐对症或支持性治疗。左西替利嗪不能通过透析有效去除,除非同时服用一种可透析药物。
左西替利嗪急性最高无毒剂量在小鼠为240mg/kg(按体表面积折算,约相当于成人临床日推荐最大口服剂量的190倍、6~11岁儿童临床日推荐最大口服剂量的230倍、6个月~5岁儿童临床日推荐最大口服剂量的180倍),在大鼠为240mg/kg(按体表面积折算,约相当于成人临床日推荐最大口服剂量的390倍、6~11岁儿童临床日推荐最大口服剂量的460倍、6个月~5岁儿童临床日推荐最大口服剂量的370倍)。
【药理毒理】
左西替利嗪
药理作用
本品为西替利嗪活性对映异构体,口服选择性组胺H1受体拮抗剂。无明显抗胆碱和抗5-羟色胺作用,中枢抑制作用较小。
毒理研究
遗传毒性
左西替利嗪Ames试验、人淋巴细胞染色体畸变试验、小鼠淋巴瘤试验和小鼠微核试验结果均为阴性。
生殖毒性
大鼠和兔经口给予左西替利嗪剂量分别达到200和120mg/kg(按体表面积折算,分别约相当于成人临床推荐最大日口服剂量的320和390倍),未见致畸性。
西替利嗪
生殖毒性
小鼠生育力和一般毒性试验结果提示,西替利嗪经口给药剂量达64mg/kg(按体表面积折算,约相当于成人临床推荐最大日口服剂量的25倍)时,对生育力无损伤。
哺乳期小鼠(母鼠)经口给药西替利嗪剂量达96mg/kg(按体表面积折算,约相当于成人临床推荐最大日口服剂量的40倍)时,可引起仔鼠体重增长延迟。Beagle犬的研究表明,给药量的大约3%经乳汁排泄。
致癌性
左西替利嗪未进行致癌性试验,西替利嗪致癌性试验可以评估左西替利嗪的潜在致癌性。大鼠连续2年经口给药的致癌性试验中,剂量达20mg/kg(按体表面积折算,约相当于成人或6个月至5岁儿童临床推荐最大日口服剂量的15倍,或6~11岁儿童临床推荐最大日剂量的10倍)时,未见致癌性。小鼠连续2年经口给药的致癌性试验中,剂量达16mg/kg(按体表面积折算,约相当于成人或6个月至5岁儿童临床推荐最大日口服剂量的6倍,或6~11岁儿童临床推荐最大日剂量的4倍)时,可引起雄性动物良性肝肿瘤的发生率增加;剂量为4mg/kg(按体表面积折算,约相当于成人或6个月至5岁儿童临床推荐最大日口服剂量的2倍,或相当于6~11岁儿童临床推荐最大日口服剂量)时,未见良性肿瘤发生率的增加。上述发现的临床意义尚不清楚。
【药代动力学】
在成年健康受试者中,左西替利嗪在治疗剂量范围内显示线性药代动力学特性,5mg口服溶液与5mg片剂间生物等效。左西替利嗪口服给药后吸收迅速且完全。成年健康受试者服用盐酸左西替利嗪口服溶液5mg后约0.5小时血药浓度达到峰值。每日口服给药的蓄积率为1.12,给药2日后达稳态。单剂量服用5mg和每日单次服用5mg的峰浓度分别为270ng/ml和308ng/ml。左西替利嗪体外平均血浆蛋白结合率约91%~92%,表观分布容积为0.4L/kg。左西替利嗪在人体内的代谢率小于给药剂量的14%,因此基因多态性或合并服用肝酶抑制剂的影响可忽略。口服溶液给药后,成人的血浆消除半衰期约8~9小时,全身清除率约0.63ml/kg/min。左西替利嗪及其代谢物主要经尿液排泄,肾清除率与肌酐清除率相关,肾功能损害者的左西替利嗪清除率下降。在吸收和清除的过程中左西替利嗪不会转换为右西替利嗪。
儿科患者:14名6~11岁、体重20~40kg的儿童单剂量口服5mg左西替利嗪的儿科药代动力学研究中,Cmax和AUC约为一项交叉比较研究中报道的成人数据的2倍多。平均Cmax为450ng/ml,平均达峰时间为1.2小时,体重标准化后,全身清除率比成人增加30%多、消除半衰期缩短24%。无专门的6岁以下儿童药代动力学研究。在323例(181例1~5岁儿童、18例6~11岁儿童、124例18~55岁成人)、单次或多次服用1.25~30mg左西替利嗪的受试者进行群体药代动力学分析,数据显示6个月~5岁儿童每日一次、每次服用1.25mg所得血药浓度与成人每日一次、每次服用5mg所得的相似。
肾功能不全:左西替利嗪在轻、中、重、末期肾功能不全患者的暴露量(AUC)与健康受试者的相比,分别增加1.8、3.2、4.3和5.7倍。半衰期预估相应分别增加1.4、2.0、2.9和4倍。口服后左西替利嗪的全身清除率与肌酐清除率相关,根据肾功能的严重程度逐步减少。因此推荐根据轻、中、重度肾功能不全患者的肌酐清除率调整剂量和给药间隔。末期肾功能疾病患者不推荐使用左西替利嗪。左西替利嗪经标准4小时透析程序清除量不超过10%。轻度肾功能不全者应减少左西替利嗪服用量,中或重度肾功能不全者的剂量及给药频率也同样需减少。(见【用法用量】)。
肝功能不全:未在肝功能不全患者研究左西替利嗪。健康受试者口服给药后的非肾清除(预示肝功能正常)约占全身清除率的28%。因左西替利嗪主要以原形经肾消除,仅肝功能不全者不可能明显降低左西替利嗪的清除。
【贮藏】
密闭,不超过25℃保存。
【包装】
口服液体药用聚酯瓶,每瓶150ml,每盒1瓶。配备有带刻度的量杯。
【有效期】
18个月。
开封后需在3个月内服用,逾期废弃。
【执行标准】
YBH00392022
【批准文号】
国药准字H20223049
【药品上市许可持有人】
企业名称:北京柏雅联合药物研究所有限公司
地 址:北京市丰台区科技园富丰路4号10A04-01
邮政编码:100070
电话号码:010-61264668
网址:www.bypharm.com
【生产企业】
企业名称: 广东众生药业股份有限公司
地 址: 广东省东莞市石龙镇西湖工业区信息产业园
邮政编码: 523325
电话号码: 0769-86100111






